

Kenniskaart - Soorten bindingen
2. http://www.aljevragen.nl/sk/atoombouw/ATM090.html
Weetjes
Dipoolmolecuul
Uit Binas tabel 40A blijkt dat de elektronegativiteit van chloor 2,8 bedraagt. De elektronegativiteit van waterstof is 2,1. Het chlooratoom trekt dus sterker aan de elektronen in de atoombinding tussen de twee atomen dan het waterstofatoom. Het gemeenschappelijk elektronenpaar is opgeschoven naar het Cl-atoom: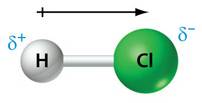
Het gevolg is dat het chlooratoom een klein beetje negatief d- is geworden en het waterstofatoom een klein beetje positief d+. De H-Cl binding is een polaire atoombinding. We noemen zo’n molecuul een dipoolmolecuul.
Effecten van waterstofbruggen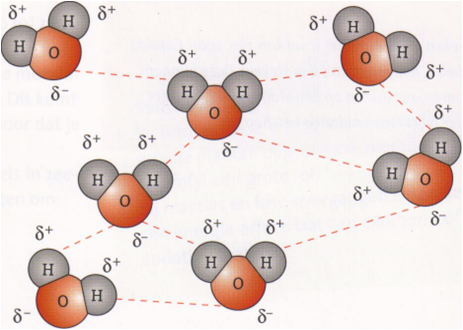
De stippellijntjes tussen de watermoleculen stellen de waterstofbruggen voor.
Door de aanwezigheid van waterstofbruggen ontstaat er een extra soort aantrek-kende kracht tussen de moleculen. Deze extra aantrekkende kracht zorgt er voor dat de moleculen moeilijker van elkaar weg zullen gaan. Dit betekent dat stoffen die moleculen bevatten die H-bruggen kunnen vormen hogere smelt- en kookpunten hebben dan stoffen met vergelijkbare molecuulmassa’s die alleen de aantrekkende vanderwaalskrachten op elkaar uitoefenen.
Voorbeeldvragen
• Atoombinding
Een atoombinding wordt gevormd door een zogenaamd gemeenschappelijk elektronenpaar tussen de atomen: één elektron van een atoom vormt samen met één elektron van een ander atoom een elektronenpaar. Voorbeelden: H2, Cl2, O2, enz.
• Polaire atoombinding
Een polaire atoombinding is een atoombinding waarbij het verschil in elektronegativiteit (Δ EN) tussen de twee ato-men ongeveer 0,4 is. Elektronegativiteit is een getal dat aangeeft hoe sterk een atoom elektronen aantrekt. Hoe groter de elektronegativiteit, hoe sterker een atoom elek-tronen aantrekt.
• Ionbinding
De ionbinding is de binding die het gevolg is van de elek-trische aantrekkingskracht tussen positieve en negatieve ionen. De sterkte van een ionbinding hangt onder andere af van de grootte van de ionladingen en van de onderlinge afstand tussen de ladingen. Een ionbinding komt voor in zouten en is een sterke binding. Meestal is Δ EN > 1,7.
• Vanderwaalsbinding
De vanderwaalsbinding is een zwakke binding tussen mo-leculen. De sterkte van de binding hangt vooral af van de grootte van het molecuul: moleculen met een grotere mas-sa oefenen een sterkere vanderwaalsbinding op elkaar uit dan moleculen met een kleinere massa. Hoe sterker de vanderwaalsbinding hoe hoger het kookpunt van een stof.
• Waterstofbruggen
In een watermolecuul komen twee O-H bindingen voor. Deze O-H binding is een polaire atoombinding. Het water-stofatoom is een beetje positief (d+ kant) en het zuurstof-atoom een klein beetje negatief (d- kant). Hierdoor zal het H-atoom van het ene watermolecuul het O-atoom van een ander watermolecuul aantrekken. Omdat de binding tussen de twee watermoleculen door een waterstofatoom tot stand komt, heet dit een waterstofbrug of H-brug.
• Polaire stoffen
Een molecuul waarin een polaire atoombinding voorkomt heeft, door het verschil in elektronegativiteit tussen de atomen, een duidelijke positieve (d+) en een duidelijk ne-gatieve (d-) kant. Een voorbeeld hiervan is een molecuul HCl. We noemen zo’n molecuul een dipoolmolecuul.
Een dipoolmolecuul is een molecuul met polaire atoom-bindingen waarin de d+ lading niet samenvalt met de d- lading.
