Groene Chemie (5hv) - Energiebalansen
Energiebalansen
In het onderdeel energiebalansen maak je kennis met:
In de chemische industrie gebruikt men veel energie. Met energie moet je zuinig omspringen niet alleen vanwege het milieu maar ook vanwege de kosten. Een slecht energiebeheer kan een fabricageproces onrendabel maken. Zowel de toevoer als de afvoer van energie in een proces kost namelijk geld |
|
1. Energiebalansen van fysische processen
Fysische processen:
- het verwarmen van een stof Hierbij geldt als formule voor de benodigde energie Q = m.c.ΔT, hierin i:
| m de massa van de stof in kg | |
| c de soortelijke warmte van de stof in kJ/kg.K (zie voor waarden: Binas) | |
| ΔT de temperatuurverandering |
- faseverandering van een stof Hierbij geldt als formule voor de benodigde energie Q = m.C, hierin is:
| m de massa van de stof in kg | |
| C de smeltwarmte of de verdampingswarmte van de stof in kJ/kg (zie voor waarden: Binas) |
Via het onderstaande stappenplan kun je een energiebalans opstellen.
| Stap 1: Stel een blokschema op |
| Stap 2: Bereken de warmtetoevoer |
| Stap 3: Stel de energiebalans op en werk deze uit |
Voorbeeld 1
Je hebt 50 kg lood bij 20 °C. Je verwarmt het lood naar 45 °C. Wat is de toename van de energie van het lood en hoeveel energie moet daarvoor worden toegevoerd?
Gegeven:
| mlood = 50 kg clood = 0,128 . 103 J/kgK ΔT = Teind – T begin = 45 – 20 = 25 °C |
Stap 1 blokkenschema
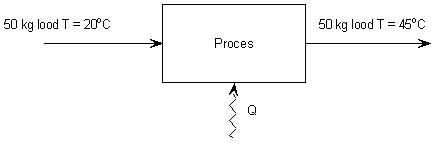 |
Stap 2 Bereken de warmtetoevoer via Q = m.c.ΔT
Q = 50 . 0,128.103 . 25 = + 1,6. 105 J
het plusteken betekent dat er energie aan het proces wordt toegevoerd: een endotherm proces.
Stap 3
De warmtetoevoer aan het lood is 1,6. 105 J, dat betekent dat de energie-inhoud van het lood met 1,6. 105 J is toegenomen.
E1 + Q = E2 hierin is E1 de energie-inhoud van het lood bij het begin en E2 de energie-inhoud van het lood aan het einde van het proces.
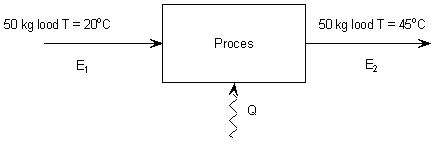 |
Het verwarmen van lood, een endotherm proces, in een energiediagram:
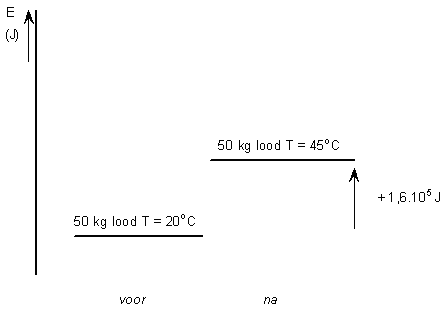 |
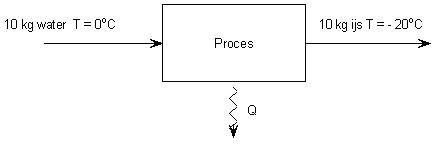
Voorbeeld 2 bevriezen en afkoelen
10 kg water van 0°C wordt omgezet in 10 kg ijs van - 20°C.
Bereken wat de afname is van de energie van het water en hoeveel energie daarvoor moet worden afgevoerd?
Gegevens
| Mwater = 10 kg cijs = 2,10 . 103 J/kgK Cijs = 334 . 103 J/kg ΔT = – 20 – 0 = 20 °C |
Stap 1
 |
Stap 2
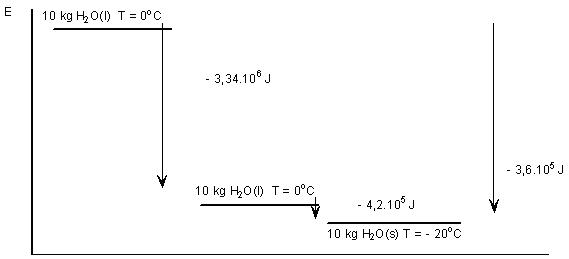
Stollen van het water tot ijs Qstollen = m . C = 10 . -334 . 103 J = -3,34 . 106 J
Afkoelen van het ijs: Qafkoelen = m . c . ΔT = 10 . 2,10 . 103 . -20 = - 4,2 . 105 J
Qtotaal = -3,34 . 106 - 4,2 . 105 = - 3,76 . 106 J.
(het minteken betekent dat er energie wordt onttrokken aan het proces)
Stap 3
 |
De energie-onttrekking aan het water is 3,7 . 106 J. Dat betekent dat de energie-inhoud van het ijs 3,7 . 106 J lager is dan van het water.
E1 + Q = E2 hierin is E1 de energie-inhoud van het water bij het begin en E2 de energie-inhoud van het ijs aan het einde van het proces.
Het bevriezen van water tot – 20 °C, een exotherm proces, in een energiediagram.
 |
Opgave 1
a. Is smelten een endotherm of exotherm proces? Licht toe. b. Is condenseren een endotherm of exotherm proces? Licht toe.
Opgave 2
a. Bereken hoeveel warmte er nodig is om 3,0 m3 water te verhitten van 25 °C tot 95 °C. b. Bereken hoeveel warmte er vrijkomt wanneer 100 kg stoom wordt afgekoeld van 200 °C tot water van 20 °C.
2. Energiebalansen van chemische processen
Bij een chemisch proces ontstaan andere stoffen, die ook een andere energie inhoud bezitten. Om het energie-effect van een chemische reactie te kunnen berekenen, maken we gebruik van het begrip vormingswarmte.
Ook bij chemische reacties geldt de wet van energiebehoud. Wanneer de totale energie-inhoud van de uitgangsstoffen groter is dan de totale energie-inhoud van de producten is er sprake van een exotherme reactie: er zal warmte vrijkomen. Bij een endotherme reactie is de totale energie-inhoud van de producten groter dan de totale energie-inhoud van de uitgangsstoffen: er moet energie toegevoegd worden.
Vormingswarmte
De vormingswarmte is de energie die nodig is om één mol verbinding te vormen uit de elementen. De vormingswarmten van de elementen zijn op nul gesteld
Bij H2(g) → H2(g) is er geen verandering in de energie-inhoud vóór en ná de reactie. Daarom kunnen de vormingswarmten van de elementen op nul worden gesteld.
Vormingswarmten staan vermeld in Binas-tabel 57A en 57B. Energiebalansen van chemische processen kun je opstellen op basis van vormingswarmten van stoffen.
Opgave 3
a. Geef de vergelijking voor de vorming van methanol uit de elementen in molecuulformules. b. Zoek in Binas de vormingswarmte van methanol op en noteer deze waarde.
Opgave 4
Leg uit of bij de volgende reactievergelijkingen de reactiewarmte gelijk is aan de vormingswarmte.
a. Ag+(aq) + Br- (aq) → AgBr (s) b. 2 Na (s) + Cl2 (g) → 2 NaCl (s) c. 2 H2O (l) → 2 H2 (g) + O2 (g)
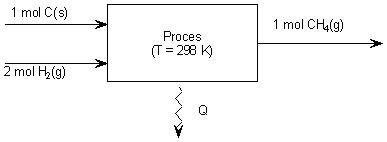
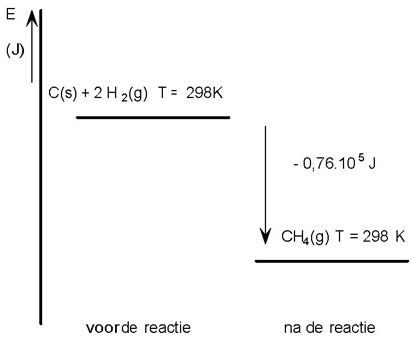
Voorbeeld 1
C (s) + 2 H2 (g) → CH4 (g) ΔEvorming = −0,76 . 105 J/mol CH4
In een blokschema:
 |
In een energiediagram:
 |
Voorbeeld 2
H2 (g) + ½ O2 (g) → H2O(g) ΔEvorming = −2,86 . 105 J/mol H2O
Er komt 2,86 . 105 J/mol H2O vrij aan warmte. Wil je het reactiemengsel niet in temperatuur laten stijgen, dan moet er aan warmte 2,86 . 105 J worden afgevoerd (Q = - ΔEvorming)
In een energiediagram:
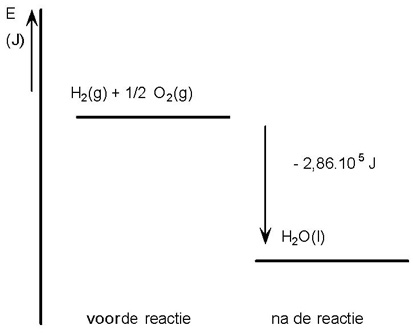 |
De energie die nodig is voor het ontleden van een verbinding is gelijk aan het tegenovergestelde van de vormingswarmte.
H2O(g) → H2 (g) + ½ O2 (g) ΔEontleding = - ΔEvorming = + 2,86 . 105 J/mol H2O
Er is voor de ontleding 2,86 . 105 J/mol H2O warmte nodig. Wil je het reactiemengsel niet in temperatuur laten dalen, dan moet er aan warmte 2,86 . 105 J worden toegevoerd (Q = - ΔEontleding)
In een energiediagram:
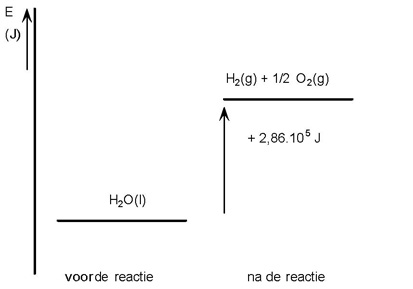 |
Voorbeeld 3
 |
Hierboven staat de ontleding van van bariumsulfaat (BaSO4) in de elementen weergegeven.
In reactievergelijking:
BaSO4 → Ba (s) + S (s) + 2 O2 ΔEontleding = +14,65 . 105 J/mol
Opgave 5
a. Leg uit hoe groot de ontledingswarmte is van calciumcarbonaat. b. Geef de bijbehorende reactievergelijking.
Opgave 6
De vormingswarmte van zwaveldioxide komt overeen met de verbrandingswarmte van zwavel. Leg dit aan de hand van een reactievergelijking uit.
Reactiewarmte
Met behulp van de vormingswarmten van stoffen, kun je de reactiewarmte uitrekenen.
Voorbeeld 4
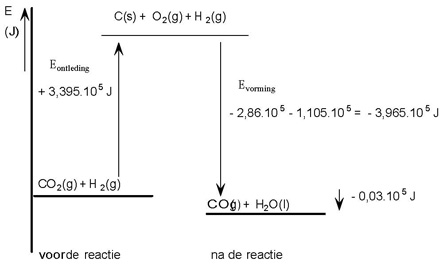
Koolstofdioxide reageert met waterstofgas tot koolstofmonooxide en water:
CO2(g) + H2(g) → CO(g) + H2O(l)
Hoe groot is de reactiewarmte voor deze reactie?
Je kunt deze totaalreactie in theorie opgebouwd denken uit meerdere reacties:
1 Je ontleedt CO2 eerst in de elementen: CO2 (g) → C(s) + O2(g) hiervoor geldt:
ΔEontleding CO2 = - ΔEvorming CO2
2 Vervolgens reageren de ontstane elementen en het al aanwezige waterstofgas met elkaar:
- Vormingsreactie water: H2(g) + ½ O2 (g) → H2O (l) ΔEvorming H2O
- Vormingsreactie koolstofmonooxide: C(s) + ½ O2 (g) → CO(g) ΔEvorming CO
In schema:
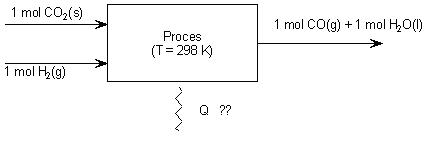 |
Ingaande stoffen:
CO2: ΔEvorming = −3,935 . 105 J/mol CO2 → ΔEontleding = + 3,935 . 105 J/mol CO2
H2: ΔEvorming = 0
Let op: de vormingswarmte van elementen is altijd gelijk aan nul.
Uitgaande stoffen:
H2O: ΔEvorming = −2,86 . 105 J/mol H2O
CO: ΔEvorming = −1,105 . 105 J/mol CO
ΔEreactie = ΔEontleding CO2 + ΔEvorming CO + ΔEvorming H2O =
+ 3,935 . 105 − 2,86 . 105 − 1,105 . 105 =
- 0,03 . 105 J
Er komt 0,03 . 105 J vrij aan warmte. Wil je het reactiemengsel niet in temperatuur laten stijgen, dan moet er aan warmte 0,03 . 105 J worden afgevoerd (Q = ΔEreactie).
In een energiediagram:
|
Opgave 7
a. Geef de reactievergelijking voor de verbranding van methaan. b. Bereken met behulp van vormingswarmten de reactiewarmte voor de verbranding van 1,00 mol methaan. c. Teken het verloop in een energiediagram.
Opgave 8
a. Geef de vergelijking voor de ontleding van 1,00 mol ammoniumchloride in ammoniakgas en waterstofchloridegas. b. Bereken met behulp van vormingswarmten de reactiewarmte voor de ontleding van 1,00 mol ammoniumchloride. c. Teken het verloop in een energiediagram.
Opgave 9
a. Geef de vergelijking voor de vorming van ethaan uit etheen en waterstof. b. Bereken met behulp van vormingswarmten de reactiewarmte voor de vorming van 1,00 mol ethaan. c. Teken het verloop in een energiediagram.
Hergebruik energie in een fabriek m.b.v. warmtewisselaar
Het is belangrijk dat een chemische fabriek zo weinig mogelijk energie moet verkrijgen door het verbranden van fossiele brandstoffen. Men stoot dan minder CO2 de lucht in en het kost ook minder geld. Twee vliegen in één klap!
Men probeert daarom zoveel mogelijk om de warmte die vrijkomt bij exotherme reacties via warmtewisselaars af te geven aan stoffen die opgewarmd moeten worden. Dit gebeurt met behulp van het tegenstroomprincipe: de vloeistof die de warmte opneemt stroomt in tegengestelde richting langs het gas of vloeistof dat de warmte afstaat. Zie tekening 4.
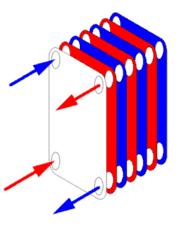 |
| Tekening 4. Bron: Wikipedia |
Dit gebeurt bijvoorbeeld bij de raffinage van ruwe aardolie. De fracties die onder in de destillatietoren worden afgetapt hebben nog een vrij hoge temperatuur en worden gebruikt om de ruwe aardolie op te warmen.
Opgave 10
In een hoogoven koelt men het ontstane vloeibare ijzer (7500 ton per dag) af van 1811 K tot 298 K.
a. Zoek het smeltpunt op van ijzer in Binas. b. Bereken hoeveel warmte per dag hierbij moet worden afgevoerd. c. Bereken hoeveel m3 water men per dag kan verhitten van 290 K tot 350 K met de warmte die door het ijzer wordt afgestaan.
Opgave 11
In een tegenstroomwarmtewisselaar wordt 12 kg rookgas per seconde van 700 K afgekoeld met water van 333 K. De waterstroom van 15 kg/s warmt op tot 363 K. Bereken de temperatuur van het rookgas bij het verlaten van de warmtewisselaar. Ga er hierbij vanuit dat alle warmte die het rookgas afstaat aan het water ten goede komt.
Gegevens:
Soortelijke warmte rookgas: 1000 J/(kg•K)
Soortelijke warmte water: 4200 J/(kg•K)
Overzichtsopgaven over Energiebalansen
Opgave 12
In hoogovens wordt het metaal ijzer gemaakt door ijzererts te laten reageren met behulp van koolstof:
Fe2O3(s) + 3 C(s) → 2 Fe(s) + 3 CO(g)
a. Bereken de reactiewarmte van deze reactie. b. Teken het energiediagram van deze reactie c. In de hoogoven wordt per dag 7500 ton ijzer geproduceerd. Bereken hoeveel warmte er per dag nodig is of ontstaat.
Opgave 13
| |
In een spiritusbrander verbrand je zuivere ethanol:
C2H5OH(l) + 3 O2(g) → 2 CO2(g) + 3 H2O(l)
a. Bereken de reactiewarmte van deze reactie.
b. Teken het energiediagram van deze reactie
Opgave 14
Bij het ontstaan van 1,0 mol ethanol ontstaat -0,45 . 105 J.mol-1. Een fabriek produceert per dag 1000 ton ethanol.
a. Bereken hoeveel J energie er per dag vrijkomt. b. De warmte die vrijkomt wordt gebruikt om water te verhitten.
Bereken hoeveel liter water je van 20 tot 100 °C kan verhitten met deze hoeveelheid water. Gebruik hierbij als soortelijke warmte van water 4,2 J.g-1.K-1. Je mag warmteverliezen buiten beschouwing laten.
Opgave 15
Carbid is CaC2(s); de chemische naam is calciumcarbide. Het wordt gemaakt door
krachtig verhitten van calciumcarbonaat(marmer) en koolstof(steenkool):
CaCO3(s) + 4 C(s) → CaC2(s) + 3 CO(g)
a. Bereken de reactie-energie per mol carbid. De vormingsenergie van carbid is -12 kJ.mol-1. b. Teken het energiediagram van deze reactie. De benodigde energie kan voor een deel verkregen worden door verbranding van het gevormde koolstofmonooxide. Men verbrandt alle verkregen koolstofmonooxide en gebruikt deze hitte om de oven te verwarmen. De verbrandingsenergie van CO(g) bedraagt -283 kJmol-1. c. Bereken hoeveel kJ nog nodig is nadat alle verbrandingsenergie van CO(g) is toegevoerd aan de oven. (Als je vraag a niet hebt, neem dan aan dat de reactie-energie + 870 kJ/mol carbid is). Als je carbid overgiet met water ontstaat ethyn, C2H2(g), ook wel acetyleen genoemd. Tevens ontstaat calciumhydroxide: CaC2(s) + H2O(l) → C2H2(g) + Ca(OH)2(s)
Van het gas ethyn wordt een deel verbrand om de energie te leveren die nog nodig is voor de bereiding van het carbid.d. Bereken hoeveel mol ethyn verbrand moet worden om de rest van de voor de oven benodigde energie te leveren. Gebruik tabel 56.
Opgave 16
Olie van 400 K en een soortelijke warmte van 1880 J/(kg.K) wordt met een snelheid van 2 kg/s gevoed aan een tegenstroom warmtewisselaar. De olie moet afkoelen tot 350 K. Er is koelwater van 280 K beschikbaar. Na het verlaten van de warmtewisselaar hebben olie en koelwater dezelfde temperatuur.
Bereken hoeveel kg koelwater per seconde nodig is om dit te bereiken.
Gegeven:
Soortelijke warmte water: 4200 J/(kg.K)
Opgave 17
In een bepaalde warmtewisselaar wordt de warmte volgens het tegenstroomprincipe overgedragen van een olie op water. Vereenvoudigd voorgesteld bestaat de warmtewisselaar uit twee concentrische buizen. Een opengewerkt gedeelte zie je hieronder.
De olie stroomt met een snelheid van 20 kg/s door de binnenbuis en koelt daarbij af van 120 °C tot 50 °C. Het water stroomt in tegengestelde richting door de ruimte tussen de binnen- en de buitenbuis (12 kg/s). De temperatuur van het binnenkomende water is 10 °C. De soortelijke warmte van het water is 2,2 keer zo groot als die van de olie. Hoewel de warmtewisselaar aan de buitenkant geïsoleerd is gaat toch 4 % van de door de olie overgedragen warmte verloren aan de omgeving.
Bereken de temperatuur van het uitstromende water.