Kenniskaart - Energiebalansen
De vorming van lachgas uit de elementen stikstof en zuurstof:
2 N2 (s) + 2 O2 (g) → 2 N2O(g)
ΔEvorming = + 0,815•105 J/mol N2O
In een blokschema:

In een Energiediagram:

Weetjes
Voorbeeldvragen
Voorbeeld Reactiewarmte
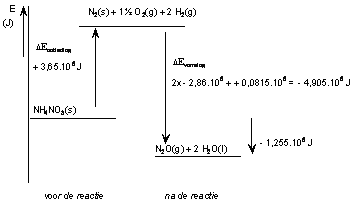
De omzetting van ammoniumnitraat in de grond onder invloed van bacteriën NH4NO3(g) (s) → N2O(g) + 2 H2O(l)
ΔEreactie = ΔEontleding NH4NO3 + ΔEvorming N2O + 2x ΔEvorming H2O = - (- 3,65.105) + (+0,815•105) −2x 2,86•105 −1,105•105 = - 1,255•105 J/mol NH4NO3
Er komt 1,255•105 J vrij aan warmte.
In een energiediagram:
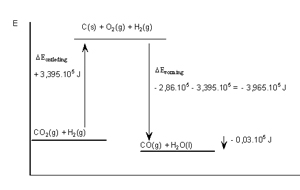
Bereken de reactiewarmte van de volgende reactie:
CO2(g) + H2(g) → CO(g) + H2O(l)
Antwoord:
ΔEreactie=ΔEontleding CO2 + ΔEvorming CO + ΔEvorming H2O =
+3,935•105 −2,86•105 −1,105•105 = -0,03•105 J.
Er komt 0,03•105 J vrij aan warmte.
In een energiediagram:
De energieverandering van een reactie kan exotherm (er komt energie vrij) of endotherm zijn (er moet continu energie worden toegevoerd.
Bij energieverandering bij fysische processen:
Q = m.c.ΔT Hierin is:
m de massa van de stof in kg
c de soortelijke warmte van de stof in kJ/kg.K (zie voor waarden: Binas)
ΔT de temperatuurverandering
faseverandering van een stof
Q = m.C Hierin is:
m de massa van de stof in kg
C de smeltwarmte of de verdampingswarmte van de stof in kJ/kg (zie voor waarden: Binas)
Energiebalans
Ebegin + Q = Eeind
Stap 1: stel een blokschema op
Stap 2: bereken de warmtetoevoer
Stap 3: Stel de energiebalans op en werk deze uit
Energieveranderingen bij chemische processen:
De energie die nodig is om een verbinding te vormen uit de elementen.
Vormingswarmten staan vermeld in Binas-tabel 57A en 57B.
NB. de vormingswarmte van elementen is altijd gelijk aan nul.
De reactiewarmte is de warmte die vrijkomt/nodig is bij een chemisch proces.
De reactiewarmte kun je berekenen met behulp van de vormingswarmten van stoffen.