

Zelfherstellend Beton (4hv) - Docentenhandleiding
Docentenhandleiding totaal pdf
PPT introductie beton (ZIP bestand incl filmpjes)
Inhoudsopgave en werkwijzer module
Welke concepten komen in de module aan de orde?
Instructie betonpers (betonpers te bestellen bij SBB: info@spelenmetchemie.nl, kosten: 30 euro)
Voorbeeldtoetsvragen zijn te vinden op het docentenforum van mijnscheikunde.nl. Om toegang te krijgen tot het forum dient u zich eenmalig te registeren. Hier zijn geen kosten aan verbonden.Uitwerkingen hieronder: (klik voor snelle navigatie)
Uitwerkingen hoofdstuk 1
Uitwerkingen hoofdstuk 2
Uitwerkingen hoofdstuk 3
Uitwerkingen hoofdstuk 4
Uitwerkingen hoofdstuk 5
Uitwerkingen hoofdstuk 6
Uitwerkingen hoofdstuk 7
Uitwerkingen hoofdstuk 8
Uitwerkingen Hoofdstuk 1 Les oriëntatie beton
Proef 1 De hydratatie van cement
Antwoorden vragen:
1.1 Een endotherme reactie is een reactie waarbij voordurend energietoevoer nodig is.
1.2 Een exotherme reactie is een reactie waarbij energie vrij komt.
1.3 De hoeveelheid energie, want bij de ene komt energie vrij en bij de andere is energie nodig.
1.4 Meet de temperatuur van het reactievat. Bij exotherm stijgt de temperatuur, bij endotherm daalt die.
1.5 De chemische reactie van cement en water waarbij cementsteen ontstaat. Cementsteen neemt water in de kristalstructuur op.
1.6 Bij deel 1 blijft de temperatuur constant en bij deel 2 stijgt de temperatuur meer dan 5°C.
Onderzoeksvraag:
Conclusie: - Hydratatie van cement is niet zomaar het mengen van stoffen, het is een chemisch proces.
Nooit cement door de gootsteen spelen. Altijd in prullenbak weggooien!
Proef 2 Zichtbaar maken van binding met water
Antwoorden vragen:
2.1 Het blijft vochtig en nat en is zeer los.
2.2 Het is een pasta; water wordt goed opgenomen
2.3 Bij deel 1 zie je het water nog.
Onderzoeksvraag:
Conclusie: - Al het water wordt gebruikt bij de uitharding (hydratatie). Er is geen water over en er is geen water verdampt.
Proef 3 Beton maken
Deel 1: mengsels maken
Werkwijze:
 | De klas wordt verdeeld in groepjes van ieder 4 leerlingen. Ieder groepje leerlingen maakt een kilo beton van een andere samenstelling. De samenstellingen zijn in tabel 1 weergegeven. Je kunt zelf natuurlijk nog meer variatie aanbrengen Maar zorg voor minimaal 3 staafjes per variatie omdat je de treksterkte van de staafjes onderling gaat vergelijken. |
Betonstaaf 1: standaard
Betonstaaf 2: twee keer zoveel water
Veel water gebruiken: het beton moet in een waterdichte vorm gegoten worden. Het voordeel is wel dat het beton in alle hoeken en gaten gaat zitten: er ontstaat veel detail in het oppervlak van het beton. Het nadeel is dat het lang duurt voordat het beton hard is.
Betonstaaf 3: de helft cement, de andere helft metselzand
Het beton wordt meer korrelig en brosser.
Betonstaaf 4: met suiker
Suiker vertraagt de bindingstijd; het beton wordt totaal niet hard misschien vanwege de kristal structuur.Betonstaaf 5: met afwasmiddel
Afwasmiddel is een plastificeerder.
Dit zijn hulpstoffen die de eigenschappen bezitten de verwerkbaarheid van betonspecie te verbeteren zonder dat hiervoor meer water moet worden toegevoegd.
Betonstaaf 6: met volièregaas
Volièregaas maakt het beton steviger.
Deel 2 Verwerkbaarheid van beton
Tabel Verwerkbaarheid van beton
| Verwerkbaarheid van beton | Treksterkte | |
| Staaf 1 | Droog aardvochtig 1-2 | 4.9 |
| Staaf 2 | Zeer vloeibaar 6 | 4.0 |
| Staaf 3 | Droog 0 | 1.5 |
| Staaf 4 | Vloeibaar 5 | 2.1 |
| Staaf 5 | Plastisch beton (zie foto 3) | 5.7 |
| Staaf 6 | volièregaas | 7.5 |
Foto’s van gebruikte materialen en grondstoffen:
 |  |
| snelcement Beamix 445 | metselzand |
 |
| plastisch beton |
Hoofdstuk 2 Beton - de grondstof water
Toelichting
In dit hoofdstuk wordt er van uitgegaan dat de leerlingen enige voorkennis hebben over:
• Atoombouw
• Atoommodel van Rutherford
• Ionen
• Periodiek Systeem der elementen
• Metalen en niet-metalen
Opdracht 2.1:
3Ag+ (aq) + PO43- (aq) → Ag3PO4 (s)
Proef 4 Zouten, het aantonen van de ionsoorten Cl- en SO42- in aanmaakwater
Aanmaakwater
Voor het bereiden van het aanmaakwater wordt gebruik gemaakt van
(synthetisch) (oppervlakte)-water. Controleer het aanmaakwater op de aanwezigheid van chloriden en sulfaten.
Uiteindelijk zal het synthetische monster aanmaakwater alleen sulfaat-ionen moeten bevatten in een concentratie van 0,10 M. Weeg hiertoe 14,2 g natriumsulfaat af in 1000 ml water.
Tip: Zorg voorafgaand aan de proef voor druppelflesjes met zoutoplossingen in een concentratie
van 0,10 M.
Veiligheid
Inventariseer en evalueer de risico’s voorafgaand aan de proef (RI&E).
Vermijd contact van de zilvernitraatoplossing met de huid. Na eventueel huidcontact direct de huid spoelen met ruim water.
Een veiligheidsbril, beschermende kleding en latex-handschoenen zijn nodig tijdens de uitvoering van de proef. Na afloop van de proef dienen de handen met water en zeep gewassen te worden.
Verder gelden de algemene veiligheidsregels tijdens practicum.
Milieu
Alle resten kunnen na afloop van de proef ingeleverd worden bij de Technisch Onderwijsassistent (TOA).
Waarnemingen/proef uitvoering
Punt 2: Het ligt voor de hand dat de leerling hier kiest voor het aantonen van het sulfaat-ion. Volgens tabel 45A is er immers geen positief ion dat enkel en alleen een neerslag geeft met chloride-ionen.
Een mogelijk positief ion volgens BINAS tabel 45A is dan het Ba2+-ion.
De oplosbaarheidstabel ziet er dan als volgt uit:
Negatief ion → | SO42- | Cl- |
| Positief ion↓ | ||
| Ba2+ | s | g |
Punt 3: Voeg ongeveer 3 mL van een oplossing van bariumnitraat toe aan het (eventueel gefiltreerde) aanmaakwater.
Er zijn nu twee mogelijkheden:
- Er ontstaat een neerslag door de (mogelijke) aanwezigheid van sulfaat-ionen in het aanmaakwater: Ba2+ (aq) + SO42- (aq) → BaSO4 (s)
- Er ontstaat geen neerslag; in het aanmaakwater zijn dus geen ...... -ionen aanwezig (niet van toepassing).
Waarneming: Er ontstaat een neerslag
Conclusie: In het aanmaakwater zijn dus sulfaat-ionen aanwezig
Opmerking: Het ontstaan van een neerslag zou in theorie ook door andere negatieve ionen in het aanmaakwater veroorzaakt kunnen worden, zoals bijvoorbeeld door fosfaat-ionen. De conclusie “In het aanmaakwater zijn dus sulfaat-ionen aanwezig” is wellicht voorbarig. Het zou beter zijn om te spreken over de mogelijke aanwezigheid van sulfaat-ionen in het aanmaakwater. Het is goed om de leerlingen bij de nabespreking van proef 5 hier op te wijzen. Een specifiekere analyse op de aanwezigheid van sulfaten test zou uitsluitsel moeten kunnen geven. Een mogelijke analyse hiervoor staat vermeld in de kanjerkaart van hoofdstuk 2.
Overigens is het gestelde bij deze opmerking eventueel te omzeilen door aan het begin van de proef te stellen dat in het aanmaakwater alleen sulfaat- en chloride-ionen mogelijk aanwezig zijn. Hierbij worden dan eventueel overige aanwezige negatieve ionen genegeerd.
Punt 4: Filtratiestap moet hier uitgevoerd worden.
Formeel zou de leerling hier moeten controleren of bij punt 3 alle sulfaat-ionen neergeslagen zijn om een eventueel vals-positief resultaat bij het aantonen van de chloride-ionen te voorkomen.
Het is goed om de leerlingen bij de nabespreking van proef 5 hier op te wijzen.
Punt 5: Een mogelijk positief ion volgens BINAS tabel 45A is het Ag+-ion. De oplosbaarheidstabel ziet er dan als volgt uit:
Negatief ion → | Cl- |
| Positief ion↓ | |
| Ag+ | s |
Punt 6: Voeg ongeveer 3 mL van een oplossing van zilvernitraat toe aan het (eventueel gefiltreerde) aanmaakwater.
Er zijn nu twee mogelijkheden:
- Er ontstaat een neerslag door de aanwezigheid van ………………..-ionen in het aanmaakwater (niet van toepassing) ………….. + ………….. → …………..
- Er ontstaat geen neerslag, in het aanmaakwater zijn dus geen chloride-ionen aanwezig.
Waarneming: Er ontstaat geen neerslag
Conclusie: In het aanmaakwater zijn geen chloride-ionen aanwezig
Opmerking:Een eventueel lichte troebeling wordt vermoedelijk veroorzaakt door het gestelde bij punt 4.
Conclusies:
| Ionsoort | Aanwezig in het onderzochte aanmaakwater | |
| Ja | Nee | |
| SO42- | Ja | |
| Cl- | Nee | |
Antwoorden opdrachten
2.2. Met behulp van een neerslagreactie is het niet mogelijk om nitraat-ionen aan te tonen. Volgens BINAS tabel 45A is er geen enkel positief ion dat een slecht oplosbaar zout geeft met NO3-
2.3. Door de chemische reactie tussen sulfaten en cementsteen kan beton aangetast worden. Hierbij is er sprake van een expansieve reactie met scheurvorming en sterkteverlies tot gevolg.
Het chloride-gehalte is met name van belang bij gewapend beton. Bij een te hoge concentratie aan chloride kan de wapening aangetast worden.
Hoofdstuk 3 De toepassing bepalat de samenstelling
Opdracht 3.1: De samenstelling van beton
a) Het is belangrijk dat eerst bekeken wordt waar het beton voor gebruikt gaat worden. Afhankelijk daarvan moet worden bepaald hoe sterk het beton moet zijn, hoeveel krachten erop komen te staan. Gebeurt dat niet dan gebeuren er ongelukken.
b) De NEN normen zijn de normen van de wet, hier moet aan voldaan worden, anders kan je aansprakelijk worden gesteld wanneer er een ongeluk gebeurt.
c)
a) Sterkteklasse
b) Milieuklasse
c) Verwerkbaarheid
d) Cementsoort
e) Toevoegingen en hulpstoffen
f) Korrelgrootte
g) Chlorideklasse
d) Dit zijn de stappen/aspecten waarmee bepaald wordt onder welke omstandigheden het beton moet functioneren.
e) Na 28 dagen heeft de chemische reactie die plaatsvindt tijdens het uitharden (de hydratatie) van beton voor een belangrijk deel plaatsgevonden. De afspraak is dat dan wordt bepaald hoe sterk het beton is geworden.
f) Te nat beton bevat te veel water. Het teveel aan water moet verdampen en dan ontstaan er luchtbellen in het beton. Het beton wordt daardoor poreuzer en dus minder sterk.
g) Grind is een opvulmateriaal, en daarnaast zorgt het ook voor een bepaalde sterkte.
h) De grindkorrel moet drie keer in de breedte passen: dus 3*18 mm = 54 mm dik beton.
i) IJzer is een metaal dat makkelijk kan roesten. Het voordeel van polymeervezels is dat ze ook heel erg sterk zijn, en het is een kunststof, dus het roest niet.
j) Cement is de ‘lijm’ in beton; het cement wordt door een chemische reactie omgezet in cementsteen en dat houdt de andere ingrediënten bij elkaar.
k) Zie stap 7, daar staan 8 voorbeelden van hulpstoffen en hun functies.
Opdracht 3.2
Het kelderdak heeft de specificaties: XC4, XD3 en XF4.
De borstwering heeft de specificaties: XC4 en XF1.
Uit tabel 1:
In de kelder zal het wisselend nat en droog zijn, meer dan bij de borstwering.
De kelder komt ook in aanraking met dooizouten via de grond, de borstwering niet, en met grondwater omdat het beton in de grond gestort wordt. Ook zal de kelder met grondvorst in aanraking komen, vandaar het verschil tussen XF4 voor in de kelder en XF1 voor de borstwering. De laatste zit veel hoger in het gebouw, dus komt niet in aanraking met de grond.
Uit tabel 2:
Beide XC4 omdat het beton in beide gevallen aan de buitenkant van het gebouw zit, en wisselend nat en droog is, en in de kelder ook nog die dooizouten dus daarom XD3.
Opdracht 3.3
1. Een geluidswal moet geluid tegenhouden, of absorberen, en het beton moet goed tegen water en dooizouten kunnen.
2. Sterkte van het beton moet bepaald worden omdat het een lang stuk is waar veel druk op komt te staan. Verder moet het beton tegen chloriden uit zeewater bestand zijn, dus daarom zeker code XS, tegen corrosie bestand zijn en het moet vloeistofdicht beton zijn.
3. Het moet radioactieve straling tegenhouden. Het beton moet honderden jaren meegaan, dus het mag ook niet poreus worden, de bewapening mag niet gaan corroderen; er is gevaar voor betonrot en het moet zo gebouwd worden dat het niet over 50 jaar zomaar afgebroken kan worden.
Opdracht 3.4
1. Code voor de geluidswal: XC4, XD3, XF4
2. Code voor de tunnel: XS2, XD2, XF4
3. Codevoor de bunker: XC4, XD3, XF3, XA3
Hoofdstuk 4 Oriëntatie zelfherstellend beton
Opdracht 4.1
a. CaCO3
b. CaCO3 → CaO + CO2
Opdracht 4.2
a. Ca3SiO5
b. 2Ca2SiO4 + 4H2O → Ca3Si2O7.3H2O + Ca(OH)2
Opmerking: Dat uit C2S dezelfde formule voor het cementsteen zou ontstaan als uit C3S is echter onwaarschijnlijk.
Opdracht 4.3
2Ca2SiO4 + 4H2O → Ca3Si2O7.3H2O + Ca(OH)2
2 mol → 1 mol
2*228,33 g = 456,66 g → 342,468 g
5000,00 g → 5000*342,468/456,66 =3749,70 g cementsteen
Opdracht 4.4
Het gaat bij de bereiding van beton niet om het cementsteen alleen, maar om het totale mengsel van zand, grind, cementsteen, calciumhydroxide.
Proef 5 Chemische tuin
Voor het maken van de chemische tuin is het handig dat je de oplossing niet hoeft te maken. Deze is verkregen via de apotheek. Die is daarna vermengd met water.
Je neemt een bekerglas en giet daarin het waterglas. |  |
Verklaring
Het natriumsilicaat is eigenlijk een soort membraan. Het zout lost voor een gedeelte op waardoor een verzadigde zoutoplossing ontstaat in een soort van bel. De ionen kunnen niet uit die bel (door het membraam van natriumsilicaat).
Omdat er een verzadigde oplossing van het zout ontstaat, gaat het zout weer uitkristalliseren. Aan een kristal groeien nieuwe kristallen in diverse richtingen. Als je goed kijkt, zie je het kristal ook daadwerkelijk groeien. De concentratie wordt weer minder, hierdoor lost weer een beetje zout op. Er ontstaat weer een verzadigde oplossing… etc… het begint weer van vooraf aan.
Deze verklaring geldt voor alle zouten.
Bij cement worden ook kristallen gevormd, zowel het cementsteen als calciumhydroxide. Ook daar spelen silicaten een rol. De snelheid van de vorming van kristallen zal zeker anders zijn, vanwege het andere medium.
Proef 6 Kristalgroei
| Kristalgroei is een leuke proef, maar deze heeft veel tijd nodig. Tijdens het maken van de oplossing waren er geen problemen. Na een paar dagen begonnen er kristallen te groeien rond het touwtje en op de bodem. Zodra er op de bodem kristallen ontstaan moet de oplossing gefiltreerd worden, anders groeien de kristallen op de bodem verder. Dan zal het uitkristalliseren vooral rond het touwtje gebeuren, waardoor grotere kristallen ontstaan. Als dat niet gebeurt, ontstaat een groot cirkelvormig kristal. Maar ook dan zijn het mooie, helderblauwe kristallen. |   |
Opdracht 4.6
a. CuSO4.5H2O → CuSO4 + 5H2O
b. CuSO4 + 5H2O → CuSO4 + 5H2O
c. Bij reactie moet verwarmd worden, dus die reactie is endotherm. Reactie b is de omgekeerde reactie en die is exotherm.
Proef 7 Bevat soda kristalwater?
Met de opstelling die zo in het practicumvoorschrift staat is het goed te doen. Alleen het verwarmen duurt vrij lang, doordat het water goed moet verdampen. Als het water in het kleine buisje komt, gaat het weer condenseren. Het heeft z’n tijd nodig. Het is goed zichtbaar aan te tonen dat in kristalsoda kristalwater zit. Na een tijdje komen er enkele druppels vloeistof op het wit koper(II)sulfaat. Het kleurt blauw, dus het is water.
Een heel simpele proef, maar erg duidelijk.
Proef 8 Hoeveel mol water bevat kristalsoda?
Massa begin (g) | Massa eind (g) |
| 42,07 | 35,49 |
Molecuulformule soda: Na2CO3• x H2O
Vergelijking: soda • water → soda + water
In formules: Na2CO3 • xH2O → Na2CO3 + xH2O
Molaire massa: (106,0 + 18,02x ) → 106,0 + x• 18,02
Eigen massa’s: 10,28 g → 3,70 g + 6,58 g
Je weet de massa van het kristalsoda voordat het in de oven ging. Door het afwegen nadat het uit de oven komt weet je de massa van het soda (zonder kristalwater).
Met behulp van verhoudingen kun je uitrekenen welke waarde x heeft.
(10.28x106.0)/(106+18.02x)=3.70
Uitwerking hiervan geeft x = 10,5
We kiezen voor x = 10, dus Na2CO3• 10H2O. Dit komt overeen met de formule (decahydraat). Mijn bevinding ligt redelijk bij de theoretische waarde. De proef is één keer uitgevoerd. Voor een hele klas levert de gemiddelde waarde een nauwkeuriger beeld.
Deze berekening is ook goed te doen voor een havo 4 leerling. Ze moeten dan wel goed nadenken, maar aan de hand van het werkblad is het goed te doen.
Opdracht 4.7
a. Water reageert met het cement tot cementsteen. Als er onvoldoende water is, kan de reactie niet volledig verlopen.
b. Bij de chemische tuin treedt kristalgroei op door de vloeistof heen. Eigenlijk lost het kristal een beetje op en kristalliseert weer uit en zo verder. Over het algemeen zijn de kristallen lang en dun, een vergelijkbare situatie bij de vorming van cemensteen.
c. Het verschil is dat bij cementsteen een reactie plaatsvindt tussen calciumsilicaat en water. Daarna kristalliseert het cementsteen uit. Bij de chjemische tuin vindt geen reactie plaats.
Opdracht 4.8
Deze opdracht lijkt kinderachtig maar is dat zeker niet. Als je op internet kijkt zie je nergens een heel bruikbaar model. Dat komt omdat beton een erg heterogeen materiaal is. Ook opnames met behulp van een elektronenmicroscoop verschillen heel sterk, afhankelijk van allerlei omstandigheden, soorten cement en verschillende toeslagmaterialen.
Een goed model van beton wordt met spanning verwacht bij info@scheikundeinbedrijf.nl.
Opdracht 4.9
a. Toeslagmaterialen kunnen sterk van vorm en grootte verschillen.
b. Het water reageert weg en op den duur is beton droog (tenminste onder droge weersomstandigheden).
Hoofdstuk 5 De zelfherstellende werking van beton
Proef 9: Zelfherstellende materialen
Deel 1: Grootmoeders wijze
Het borstplaat is goed te maken als het voorschrift goed wordt gevolgd.
De krassen in het borstplaat blijven bestaan.
Deel 2: Zelfherstellende materialen is lastiger.
Het koken tot de gewenste concentratie (dikte) is erg belangrijk. De vlam moet daarbij niet te hoog zijn, anders wordt het borstplaat te bruin. Geduld is belangrijk.
De krassen in het borstplaat verdwijnen op den duur. Borstplaat gemaakt met azijn heeft zelfherstellende eigenschappen.
Proef 10: Zelfherstellende werking van beton
Bij de proef is het belangrijk van te voren na te gaan welke tijd nodig is om de betonstaven te breken en daarna weer aan elkaar te bevestigen met post-elastiek. Na ca. twee dagen moet de staaf weer aan elkaar vastzitten.
Als dat niet het geval is (temperatuur en vochtigheid zijn hierbij erg belangrijk) dezelfde proef met meerdere betonstaafjes uitvoeren en na tussen 3, 4, 5 en 6 uur de staven breken en na twee dagen controleren bij welke tijd de staven aan elkaar zijn gebleven
Deze proef is discutabel. De hydratatie van het cement heeft nog maar kort plaatsgevonden. Als je dan een breuk maakt is het begrijpelijk dat de kans redelijk groot is dat de staven weer aan elkaar ‘groeien’. Toch lijkt deze situatie op die waarbij een (micro)scheur in uitgehard beton ontstaat. In deze staven zit nog veel ongereageerd cement. Dat kan verder reageren en de staven zitten weer (weliswaar zwakker gebonden) aan elkaar.
Bij het maken van microscheuren zijn opnames met de elektronenmicroscoop wel zo te maken dat de zelfherstellende werking zichtbaar is, maar de ontwikkelaars wilden graag een proef die het principe van de zelfherstellende werking het duidelijkst zou laten zien.
Opdracht 5.1
a. Uitgaande van C2S:
2Ca2SiO4 + 4H2O → Ca3Si2O7.3H2O + Ca(OH)2
en vanuit C3S:
2Ca3SiO5 + 6H2O → Ca3Si2O7.3H2O + 3Ca(OH)2
b. In afbeelding 5b (onderdeel 6 en 7).
c. Na het ontstaan van een microscheur kan er als het beton nat wordt gemakkelijk water komen op de plaats van de scheur. Daar kan nog aanwezig ongereageerd cement met water weer gewoon cementsteen geven (reactie zie a.).
d. Op die plaatsen waar een microscheur is ontstaan en vervolgens is hersteld zal een volgende keer minder ongereageerd cement aanwezig zijn (of misschien wel helemaal niet meer). Dus op den duur verdwijnt de zelfherstellende werking.
Opdracht 5.2 Webquest
Het is erg uitdagend aan een opdracht te werken die een kans maakt op de website van scheikunde in bedrijf geplaatst te worden.
Een aantal links naar websites die iets van doen hebben met zelfherstellend beton:
http://agrabeton.cementenbeton.nl/index.php?option=com_content&task=view&id=122&Itemid=9
http://www.citg.tudelft.nl/live/pagina.jsp?id=d6b29f69-f453-40e6-b6cb-01714077ed69&lang=nl
http://www.kennislink.nl/web/show?id=135593
Eventueel kan het artikel beoordeeld worden met een cijfer, al dan niet in combinatie met het vak Nederlands.
Extra opgave: Zelfreparerend beton
Intermediair, 8 maart 2001 
Planten en dieren herstellen hun eigen wonden. Geen gek idee, vinden technici. Ze werken aan zelfherstellende materialen voor onverwoestbare autoruiten, koffiekopjes, bruggen en vliegtuigonderdelen. Zo is er ook zelfreparerend beton ontwikkelt.
Beton is een hard, steenachtig materiaal. Als het te zwaar wordt belast, ontstaan er haarscheuren (heel kleine scheuren) die steeds groter kunnen worden. Als de haarscheuren tijdig worden gerepareerd, scheurt het beton niet verder. Bij zelfreparerend beton zijn de benodigde stoffen al in het beton aanwezig.
Het herstelproces van beton verloopt via een aantal deelstappen. De eerste stap is de omzetting van het aanwezige ureum in ammoniak en koolstofdioxide. Dit gebeurt met bacteriën.
Opgaven
1 Wat is er nog meer nodig om deze omzetting gerealiseerd te krijgen?
Ureum heeft als formule NH2-CO-NH2. Ureum reageert met water tot ammoniak en koolstofdioxide.
2 Geef de omzetting van ureum in de genoemde stoffen in een reactievergelijking weer.
3 Geef de vergelijking van de reactie die bij het laatste plaatje hoort.
4 Waarom stopt de productie van ammoniak en koolstofdioxide als de scheur in het beton gedicht is?
Antwoorden
1 Er is zuurstof nodig die de aanwezige bacteriën aanzet tot de omzetting van ureum in koolstofdioxide en ammoniak.
2 NH2-CO-NH2 + H2O → 2 NH3 + CO2
3 Ca2+ + CO32- → CaCO3
4 Dan kan er geen zuurstof meer bij de bacteriën komen en stoppen de bacteriën met de omzetting van ureum in ammoniak en koolstofdioxide.
Hoofdstuk 6 Onderzoek
Antwoorden/uitwerkingen Onderzoeks opdrachten
Opmerking
Tot nu toe zijn de keuzeopdrachten 6.1 en 6.2 en onderzoeksopdracht 6.3 uitgevoerd en van commentaar voorzien.
Zodra we gegeven over de andere oprachten hebben worden ze hier opgenomen.
Keuzeopdracht 6.1. De olifanten van beton
 |
| bron Tom Claassen, Olifanten, 1999, foto Patrick Post |
Antwoorden De olifanten van beton
Éen olifant heeft ongeveer een volume van 690 cm bij 1100 cm bij 690 cm, dus dat is 523 m3. Vermenigvuldigen met de dichtheid van beton: 523 * 2500 = 1309275 kg, is 1,3* 106 kg. Volgens wikipedia weegt één olifant ongeveer 4,0*104 kg. Dat scheelt dus nogal!
Dat komt omdat ze gemaakt zijn van spuitbeton. Spuitbeton of Shotcrete is een vorm van beton dat in vloeibare, natte verschijning spuitbaar aangebracht kan worden. Het wordt veel gebruikt bij de aanleg van tunnels, en kunstwerken. Het cement wordt van tevoren gemengd met water en door de slang geleid, waarbij alleen lucht onder hoge druk toegevoegd wordt. Voordeel van de natte methode is minder stofontwikkeling en snellere hechting aan het te spuiten oppervlak.
De olifanten zijn dus eerst gemaakt van kippengaas en piepschuim, dat ook nog eens in de fik gestaan heeft tijdens het maken van het kunstwerk, met daaroverheen een dunlaagje spuitbeton.
Bekijk ook de site van de kunstenaar.
Olifanten: informatie
Tom Claassen, Olifanten,1999, foto Patrick Post
Wat: Hoewel ze geen slagtanden hebben, niet de typerende nagels aan hun voeten en nergens huidplooien, zijn ze toch onmiddellijk herkenbaar als olifanten. Vijf grote knuffels langs de snelweg. Gemaakt van stalen balken, staaldraad, piepschuim en spuitbeton. En toch aaibaar, lijkt het.
Volgens Claassen zelf zijn het 'dingen die op afstand aan een olifant doen denken', maar dat is wel erg zwak uitgedrukt. Niemand zal ook maar één moment aan iets anders denken dan aan een kudde olifanten, als hij langs dit grijze vijftal rijdt. Doordat ze allemaal in een andere richting gedraaid staan, laten ze zich van alle kanten bekijken.
Claassen maakte modellen van 50 cm lang en liet de beelden vervolgens uitvoeren door een aannemer. Zeven meter hoog, zeven meter breed en elf meter lang zijn de maten - per dier. Het project was begroot op acht ton, maar werd een tikkie duurder door een ongelukkige brand in de werkruimte waar de beelden werden gemaakt. Het piepschuim waarmee de vormen werden opgebouwd, vloog in brand en twee olifanten raakten ernstig beschadigd. Nu staan ze dan veilig in beton gegoten, brengen kinderen in verrukking en volwassenen in verwarring.
Beeldhouwer Tom Claassen heeft meer abstracties van dieren in de openbare ruimte neergezet. Hij kiest vaak voor vriendelijke, soms wat karikaturale beesten. Op een dak in Haarlem zitten bijvoorbeeld vier kolossale mussen met parelkettingen om. Ook in Utrecht maakte hij speciaal voor de expositie Panorama 2000 -kunst vanaf de Domtoren- een mus van zo'n vijf bij acht bij vier meter, die op het dak van een huis aan de voet van de toren zat. Geen dieren, maar al even aimabele figuren maakte Claassen voor de vertrekhal van Schiphol, waar twee reusachtige poppen als verloren kinderspeelgoed wachten op een eerlijke vinder.
Waar: Knooppunt A27/A6
Wie: Tom Claassen (1964). Meer werk is o.a. te zien in Haarlem (mussen), in Utrecht op het slachthuisterrein (paard), in de vertrekhal van Schiphol (twee poppen) en in een sluis bij IJburg (nijlpaard).
Karin van Munster http://www.cultuurwijs.nl/cultuurwijs.nl/cultuurwijs.nl/i000775.html
Keuzeopdracht 6.2. Een betonnen boot
Antwoorden: Een betonnen bootBelangrijk is dat het bootje blijft drijven. Het bedenken van een binnen mal en een buitenmal is nog best lastig. Leerlingen hebben vaak creatieve ideeën en beoordeel per idee de haalbaarheid van het project. Het is het verstandigst om met snelcement te gaan werken en niet met beton aan de slag te gaan. Let er wel op dat de dunne wandjes snel kunnen breken en dat er zeker gebruik gemaakt moet worden van kippengaas.
De berekeningen kunnen stap voor stap gevolgd worden.
1. Bootje blijft niet drijven. Er wordt niet voldaan aan de voorwaarde: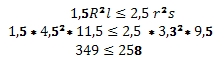
en dat klopt niet
2. Deze blijft wel drijven:
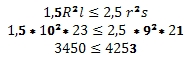
En dat klopt wel.
3. Nee, dat brokkelt heel snel kapot. De randen moeten echt versterkt worden met kippengaas.
Onderzoeksopdracht 6.3 / kanjerkaart opdrachten
Toelichting
Het in de kanjerkaart genoemde literatuuronderzoek naar het versnellen van het zelfherstellende vermogen van beton met bacteriën is zeer aan te bevelen. Het betreft hier een actueel onderzoek aan o.a. de Technische Universiteit Delft.
De overige genoemde onderzoeken in de kanjerkaart zijn lang niet allemaal in de praktijk getest op haalbaarheid. Het betreft hier meer een verzameling ideeën van mogelijke onderzoeken aan beton.
Met enkele onderzoeken uit de kanjerkaart is wel enige ervaring opgedaan. De opzet van deze onderzoeken en de resultaten ervan staan hieronder beschreven.
Ervaringen en resultaten van een tweetal onderzoeken aan beton.
Er is een aantal factoren dat mogelijkerwijs van invloed kan zijn op het zelfherstellend vermogen van het beton.
Hierbij is praktisch onderzoek gedaan naar de:
1. Invloed van de hoeveelheid cementpoeder op het zelfherstellend vermogen;
2. Invloed van de aanwezigheid van CO2 op het zelfherstellend vermogen.
Ad. 1 Meer cementpoeder zal leiden tot meer ongehydrateerde cementkorrels. Dit leidt tot de volgende hypothese: Naarmate de betonspecie in verhouding meer cementpoeder zal bevatten, zal het zelfherstellende vermogen van het beton toenemen.
Ad.2 De aanwezigheid van opgelost koolstofdioxide in water leidt tot een reactie tussen het in het poriewater aanwezige calciumhydroxide en koolzuur waarbij calciumcarbonaat en water ontstaat. Door deze neutralisatiereactie wordt de pH van beton verlaagd.
Wat precies de gevolgen hiervan zijn voor het zelfherstellend vermogen van het beton is moeilijk aan te geven, maar met behulp van dit experiment is dit proefondervindelijk vast te stellen.
Het experiment wordt uitgevoerd met twee verschillende soorten mineraalwater, namelijk koolzuurvrij en koolzuurhoudend mineraalwater.
Onderzoeksvraag: “Op welke wijze is het zelfherstellend vermogen van beton te vergroten?”
Inleiding
Het onderzoek richt zich op de invloed van de hoeveelheid cementpoeder en de aanwezigheid van CO2 op het zelfherstellend vermogen van beton.
Voor het onderzoek moeten er betonblokjes gemaakt worden.
De standaard werkwijze voor het maken van de betonblokjes is als volgt:
1. Weeg 500 gram betonmortel af in een oude pan;
2. Voeg 100 mL leidingwater toe;
3. Roer het mengsel totdat er een homogene brij is ontstaan;
4. Giet het mengsel over in een frikadellenbakje;
5. Laat het geheel nu minimaal twee dagen drogen aan de lucht.
6. Maak m.b.v. een spijker een kras (lengte 5 cm, breedte 1 mm, diepte 1 mm) in het betonnen blokje;
7. Maak m.b.v. een spijker nog een kras in het betonnen blokje, maar nu zeer oppervlakkig, met een lengte van 5 cm
8. Maak een foto van het blokje;
9. Plaats het blokje in een bak met leidingwater waarbij het blokje volledig onder water moet liggen;
10. Volg het zelfherstellend proces van het beton gedurende minimaal één week,
maak hierbij, indien mogelijk gebruik van een binoculair of digitale microscoop en maak
foto’s.
11. Meet, indien mogelijk, de kras op.
Opmerking: Indien nodig kunnen de dimensies van de kras uit punt 6 bijgesteld worden.
Het uitgangsmateriaal voor het praktisch onderzoek is de betonmortel 100 van het merk Beamix van de fabrikant Maxit.
Eventuele conclusies van het onderzoek zullen gebaseerd zijn op de snelheid waarmee het beton zich herstelt. Met andere woorden, in welke van de geteste situaties is de kras het snelst verdwenen en daardoor niet meer zichtbaar.
Hierbij gelden de volgende randvoorwaarden:
• De krassen van de verschillende betonblokjes moeten zoveel mogelijk gelijke dimensies hebben wat betreft punt 6 en 7 van de werkwijze van deel 1 van het onderzoek;
• De verschillende betonblokjes moeten op hetzelfde tijdstip ingezet worden wat betreft punt 9 van de werkwijze van deel 1 van het onderzoek;
• Het onderzoek wordt in duplo uitgevoerd.
Resultaten van het praktisch onderzoek 1
1. Onderzoek naar de invloed van de hoeveelheid cementpoeder op het zelfherstellend vermogen van beton
In dit onderzoek zijn er betonblokjes gemaakt waarbij er aan de betonmortel naar verhouding steeds meer cementpoeder is toegevoegd. In tabel 1 staan per betonblokje de verhouding betonmortel/cementpoeder vermeld.
Tabel 1: Overzicht van de verschillende mengverhoudingen betonmortel/cementpoeder
Code betonblokje | Mengverhouding betonmortel/cementpoeder in gram |
5 | 500 / 0 |
4 | 400 / 100 |
3 | 300 / 200 |
2 | 200 / 300 |
Dit deel van het onderzoek heeft veertien dagen geduurd. In totaal zijn er veertien keer visuele waarnemingen uitgevoerd.
Uit de resultaten van de oppervlakkige kras blijkt het volgende:
• Bij de twee betonblokjes die alleen van betonmortel zijn gemaakt, is er nauwelijks sprake van een zelfherstellend effect. Blijkbaar heeft al het aanwezige cementpoeder gereageerd met water tijdens het hydratatieproces;
• Min of meer hetzelfde geldt voor de betonblokjes waaraan 400 gram betonmortel 100 gram cementpoeder toegevoegd is;
• De betonblokjes met samenstelling 300 gram betonmortel en 200 gram cementpoeder geven na drie dagen al redelijk herstel te zien, na tien dagen zijn de krassen bijna helemaal verdwenen;
• Min of meer hetzelfde geldt voor de betonblokjes waaraan 200 gram betonmortel 300 gram cementpoeder toegevoegd is, na vier dagen zijn de krassen bijna helemaal verdwenen;
• De diepere krassen zijn in alle betonblokjes nauwelijks hersteld.
Conclusie
De betonblokjes die gemaakt zijn op basis van 200 gram betonmortel en 300 gram cementpoeder laten het snelste herstel van de krassen zien. Een volledig herstel is echter in de onderzoeksperiode niet waargenomen.
Discussie
Voor een volledig herstel van de krassen is waarschijnlijk meer tijd nodig.
Op basis van de resultaten van het zelfherstellende vermogen zou voor het onderzoek naar de invloed van CO2 op het zelfherstellend vermogen van beton eigenlijk verder gewerkt moeten worden met de samenstelling van 200 gram betonmortel en 300 gram cementpoeder, maar in de praktijk was dit mengsel toch ook al wel lastig te verwerken op basis van 100 mL water. Daarom is besloten om voor het vervolgonderzoek gebruik te maken van de samenstelling 300 gram betonmortel en 200 gram cementpoeder. Dit betekent wel dat de experimenten minimaal 10 dagen moeten duren.
Resultaten van het praktisch onderzoek 2.
2. Onderzoek naar de invloed van CO2 op het zelfherstellend vermogen van beton
In totaal zijn er vijf betonblokjes gestort op basis van het mengsel 300 gram betonmortel en 200 gram cementpoeder.
Eén blokje dient als referentie en is niet in contact geweest met water. Twee blokjes hebben gedurende 10 dagen in koolzuurvrij mineraalwater gelegen. De overige twee blokjes zijn in contact geweest met koolzuurhoudend mineraalwater. Het experiment is uitgevoerd zonder contact met de buitenlucht. Per blokje zijn er nu vier krassen gezet, twee oppervlakkige en twee diepere.
In totaal zijn er vijf keer visuele waarnemingen uitgevoerd. Verder herstel van de oppervlakkige krassen was niet meer waarneembaar.
Uit de resultaten van de twee oppervlakkige krassen blijkt het volgende:
• Bij de twee betonblokjes die in contact met het koolzuurvrije mineraalwater zijn geweest, zijn de oppervlakkige krassen na drie dagen bijna helemaal verdwenen;
• Na een periode van 10 dagen hebben deze krassen zich niet meer verder weten te herstellen;
• De diepere krassen bij deze blokjes zijn na tien dagen nog wel gedeeltelijk te zien;
• De twee betonblokjes die in het koolzuurhoudende mineraalwater hebben gelegen, zijn de krassen na drie dagen deels wel en deels niet meer waarneembaar;
• Ook voor deze blokjes geldt dat na een periode van tien dagen het herstel niet verder meer waarneembaar is;
• Wat verder nog wel van belang is, is dat de blokjes na contact met koolzuurhoudend mineraalwater na enkele uren drogen behoorlijk wit zijn uitgeslagen.
Extra: Er zijn ook monsters genomen van het mineraalwater waarin de betonblokjes liggen.
Van deze monsters zijn met behulp van een analoge pH-meter de pH-waardes na 5 dagen bepaald. De resultaten zijn opgenomen in tabel 2. De kolom “pH-waarde (volgens etiket)” heeft betrekking op de pH-waarde van het mineraalwater dat niet in contact is geweest met de betonblokjes. Deze waardes zijn overgenomen van het etiket op de fles.
Een controlemeting van de pH van het koolzuurhoudende mineraalwater direct uit de fles levert een pH-waarde van 5.6 op.
Tabel 2: pH-waardes van het mineraalwater waarin de blokjes hebben gelegen
Soort mineraalwater | pH-waarde (volgens etiket) | pH-waarde gemeten na 5 dagen contact met betonblokjes |
Koolzuurvrij | 7.5 | 11.5 |
Koolzuurhoudend | 5.5 | 6.9 |
Conclusie
De snelheid waarmee de oppervlakkige krassen zich herstellen in koolzuurvrij mineraalwater is redelijk vergelijkbaar met leidingwater. Bij de blokjes in koolzuurhoudend mineraalwater duurt het herstel wat langer.
Discussie
Het waarnemen van het herstel van de krassen bij het koolzuurhoudend mineraalwater wordt bemoeilijkt door een witte uitslag van het beton. Deze witte uitslag wordt veroorzaakt door calciumcarbonaat als gevolg van carbonatatie. Door de aanwezigheid van CO2 ontstaat er koolzuur. Het in het beton aanwezige calciumhydroxide reageert met koolzuur tot calciumcarbonaat. Daarnaast heeft deze reactie tot gevolg dat de pH van het koolzuurhoudende mineraalwater minder sterk stijgt dan de pH van het koolzuurvrije mineraalwater.
Algehele conclusie
Terugkomend op de onderzoeksvraag “Op welke wijze is het zelfherstellend vermogen van beton te vergroten?” is het mogelijk om uit de onderzoeksresultaten een aantal conclusies te trekken.
Door het toevoegen van relatief veel cementpoeder aan het mengsel, waarvan het beton uiteindelijk wordt gemaakt, is het mogelijk om het zelfherstellende vermogen van het beton te vergroten.
Nader onderzoek zal moeten uitwijzen wat de invloed op de sterkte van het beton is bij het gebruik van extra cementpoeder.
Als beschadigd beton in contact komt met koolzuurvrij mineraalwater is het herstellend vermogen van beton vergelijkbaar met leidingwater. Koolzuurhoudend mineraalwater lijkt een nadelig effect op het zelfherstellend vermogen van beton te hebben. Eventueel vervolgonderzoek kan zich richten op de invloed van regenwater. De praktijk is namelijk dat eventueel beschadigd beton eerder in contact komt met regenwater dan met leiding- of mineraalwater.
Veiligheid
Inventariseer en evalueer de risico’s voorafgaand aan de proef (RI&E).
Een veiligheidsbril en beschermende kleding zijn nodig tijdens de uitvoering van de experimenten.
De werkzaamheden ten aanzien van het maken van de betonblokjes (het afwegen van het cementpoeder, het toevoegen van water, roeren) dienen in een zuurkast te plaats te vinden. Hierbij is het dragen van latex-handschoenen nodig.
Na afloop van de experimenten dienen de handen met water en zeep gewassen te worden.
Verder gelden de algemene veiligheidsregels tijdens practicum.
Milieu
Alle resten kunnen na afloop van de proef ingeleverd worden bij de Technisch Onderwijsassistent (TOA).
Visuele beoordeling zelfherstellend vermogen
Onderzoek naar de invloed van ………………………………………………………… op het zelfherstellend vermogen van beton
Datum van bekrassing betonblokjes en onder water zetten:
Datum :
Tijd :
Code beton | Oppervlakkige kras | Diepere kras |
Kras nog gedeeltelijk te zien : -
Kras wel of niet te zien : ±
Kras bijna helemaal verdwenen : +
Kras volledig verdwenen : ++
Het uitgangsmateriaal is de betonmortel 100 van het merk Beamix van de fabrikant Maxit.
Voor het cementpoeder is gebruik gemaakt van cement 800 van het merk Beamix van de fabrikant Maxit.
Aanvulling op keuzeopdracht 3
Uitwerkingen eigen bevindingen
Deze resultaten zijn verkregen d.m.v. het zelf uitvoeren van de proeven.
Resultaten hoeveelheid water variatie
| Bak nr. | Gewicht breuk (kg) | Variabele | Gewicht zelf herstellende breuk (kg) |
| 1 | Het normale beton kan een kracht weerstaan van 37 kg. Als deze twee weken heeft uitgehard. | Alleen de breuk bevochtigen | 2 |
| 2 | < 0,5 | ||
| 3 | 1,7 | ||
| 4 | Breuk bevochtigen en extra water toevoegen | < 0,5 | |
| 5 | < 0,5 | ||
| 6 | 1,3 | ||
| 7 | Gehele bakje vullen met water | 0,95 | |
| 8 | Niet zelf herstelt | ||
| 9 | <0,5 |
Resultaten pH variatie
| Bak nr. | Gewicht breuk (kg) | Variabele | Gewicht zelf herstellende breuk (kg) |
| 1 | Het normale beton kan een kracht weerstaan van 37 kg. Als deze twee weken heeft uitgehard. | Voeg water toe met ongeveer pH 5 | Niet zelf herstelt |
| 2 | < 0,5 | ||
| 3 | 0,7 | ||
| 4 | Voeg water toe met ongeveer pH 7 | 1,5 | |
| 5 | 2 | ||
| 6 | 1,7 | ||
| 7 | Voeg water toe met ongeveer pH 9 | 1,4 | |
| 8 | 1,8 | ||
| 9 | <0,5 |
Conclusie
Duidelijk aan proef 1 (variatie hoeveelheid water) is te zien dan hoe meer water je toevoegt hoe zwakker het beton wordt. Het gaat schilferen en valt sneller uit elkaar, dan wanneer je alleen de breuk bevochtigt.
Er komt ook duidelijk naar voren in proef 2 (variatie pH) dat een zuur milieu slecht is voor het zelfherstellend vermogen van het beton. Een onderscheid tussen een neutraal en basisch milieu kwam niet duidelijk naar voren.
Het beste/sterkte zelfherstellend beton is als je het na het breken met een neutrale/basische oplossing bevochtigt (dus niet te veel water gebruiken).
Tegenvallers
In dit onderzoek heb ik een aantal tegenslagen moeten verwerken. Ten eerste moet ik een goede manier vinden op representatief de breekkracht van het beton te meten. Daar is jammer genoeg veel tijd aan verloren gegaan.
Ten tweede kwam niet duidelijk naar voren dat er een verschil zou kunnen zijn tussen een neutrale of basische oplossing. Maar dit zou je nogmaals kunnen onderzoeken d.m.v. grotere verschillen tussen de zuurgraad. Maar dit garandeert niet dat er daadwerkelijke een verschil is.
Ten slotte wilde ik nog meten wat het effect is van de temperatuur van het zelfherstellend vermogen. Jammer genoeg ben ik hier niet aan toegekomen wegens het niet op tijd breken van mijn beton waardoor het te veel uitgehard was.
 |  |
Hoofdstuk 7: Theorieblad zouten
N.B. Te gebruiken als het onderwerp zouten nog niet is behandeld.
Uitwerkingen
Opdracht 7.1
a. Ba2+; b. Mg2+; c. F-; d. OH-; e. Al3+.
Opdracht 7.2
a. CaS; b. SnBr2; c. (NH4)3PO4; d. AgI; e. Fe3(SO4)3
Opdracht 7.3
a. magnesiumoxide; b. natriumsulfaat; c. calciumbromide, d. kaliumhydroxide;
e. lood(II)nitraat.
Opdracht 7.4
a. Na2CO3 → 2Na+(aq) + CO32-(aq)
b. NH4Cl → NH4+(aq) + Cl-(aq)
Opdracht 7.5
a. Zn2+(aq) + S2-(aq) → ZnS(s)
b. Ba2+(aq) + SO42+(aq) → BaSO4(s) en Al3+(aq) + 3OH-(aq) → Al(OH)3(s)
Opdracht 7.6
Pb2+ en Cl- 5 loodionen en 1 chloride ion geeft 10+ en 1- = 9+. De formule is neutraal; fosfaat is 3-, dus er zijn 3 fosfaationen. De formule van pyromorfiet is Pb5Cl(PO4)3 .
Opdracht 7.7
a. Zn(NO3)2 en Pb(NO3)2
b. Toevoegen van een opgelost jodidezout aan een oplossing van het verontreinigde zinknitraat geeft bij aanwezigheid van lood(II) een neerslag van loodjodide. Ook is het mogelijk een sulfaat te nemen. Bij aanwezige verontreiniging van lood(II) slaat loodsulfaat neer.
BINAS tabel 45A):
I-(aq) | SO42-(aq) | |
Pb2+(aq) | s | s |
Zn2+(aq) | g | g |
Opdracht 7.8
a. Mg3(PO4)2
b. Aan een oplossing van een magnesiumzout in water (bijvoorbeeld magnesiumchloride) wordt natriumfosfaat toegevoegd. Er ontstaat een neerslag van magnesiumfosfaat. Filtreer het neerslag en droog het.
PO43-(aq) | |
Mg2+(aq) | s |
Opdracht 7.9
Probeer van alle zouten iets op te lossen in water. Er is maar een zout dat niet oplost, ijzer(III)fosfaat.
Voeg aan oplossingen van wat van de zouten uit de resterende drie buizen een beetje natriumchlorideoplossing toe. Het opgeloste zilvernitraat geeft slechts een neerslag van zilverchloride.
Neem wat van de zouten van de twee overgebleven buizen en los die op in water. Voeg wat bariumchloride oplossing toe. Het opgeloste magnesiumsulfaat geeft een neerslag van bariumsulfaat.
Opdracht 7.10
a. Er zijn twee formules tricalciumsilicaat ,Ca3SiO5 en dicalciumsilicaat, Ca2SiO4 en die zijn allebei goed.
b. AlO33-
c. CaSO4.2H2O
d. 2Ca2SiO4 + 4H2O → Ca3Si2O7.3H2O + Ca(OH)2
Hoofdstuk 8: Theorieblad Mol
Opdracht 8.1
a. 5,00 : 1,43 = 3,49 gram koper reageert er met 1,00g zwavel, dus 3,39 x 5,00 = 17,48g koper reageert er met 5,00g zwavel.
b. 5,00g + 17,48 = 22,48g (wet van massabehoud)
Opdracht 8.2
a. 2 CO + O2 → 2 CO2
b. Massa voor de pijl : 2x(12,01+16,00) + 2x 16,00 = 88,02g
Massa na de pijl : 2x (12,01 + 2x16,00) = 88,02g
Massa voor de pijl gelijk aan massa na de pijl, dus ja in overeenstemming met de wet van massabehoud. (wet van massabehoud zegt niets over het aantal mol, maar over de massa)
c. 2 : 1 : 2
d. 2x(12,01+16,00) : 2x 16,00 : 2x (12,01 + 2x16,00)
56,02 : 32 : 88,02
e. Zie antwoord b.
Opdracht 8.3
a. Cl2 + H2 → 2 HCl
b. 1 mol : 1 mol : 2 mol
c. 70,90gram : 2,016 gram : 72,92 gram
d. 70,90/2,90 : 2,016/0,08 : 72,92/1,49 = 24,4 : 24,6 : 48,9
e. Alles delen door 24,4 geeft
1 : 1 : 2
f. klopt (als dit niet het geval is, overleg met je docent)
Opdracht 8.4
a. 25 g / 12,01 = 2,08 mol
b. 0,02 x 2,016 x 1000 = 40,32 mg
c. 30 /1000 x 55,85= 1,68g
d. 5,00 / 20,18 = 0,248 mol, dus 0,248 x 6*1023 = 1,47*1023
Opdracht 8.5
a. CaSiO3
b. 40,08 + 28,09 + 3 x 16,00 = 116,17 g/mol
c. –
Opdracht 8.6 havo
a. 40,08 + 2x(16,00 +1,008) = 74,096 g/mol
b. 2 * 228,33 g + 6 * 18,016 g → 342,468 g +3 * 74,096
456,66 + 108,096 = 342,468 + 222,288
Voor de pijl en na de pijl beide totaalmassa’s 564,746g, dus ja het klopt
c. 1 kg = 1000g, dus 1000:342,468 x 108,096= 315,6 g
Opdracht 8.6 vwo
a. 3x 40,08 + 2x28,09 + 7x16,00+3x(2x1,008+16,00) = 342,468 g/mol
b. 2 * 228,33 g + 6 * 18,016 g → 342,468 g + 3 * 74,096
456,66 + 108,096 = 342,468 + 222,288
Voor de pijl en na de pijl beide totaalmassa’s 564,746g, dus ja het klopt
c. 1 kg = 1000g, dus 1000/342,468 x 108,096 = 315,6 g
Opdracht 8.7
a. Bij de reactie komt warmte vrij, dus gaat het om een exotherm proces.
b. Ca2SiO4; de molaire massa bedraagt 2x 40,08 + 28,09 + 4x16,00 = 172,25 g/mol
c. Een hydraat is het reactieproduct van een zout met water waarbij het water als kristalwater in het rooster is opgenomen.
Opdracht 8.8
a. 4CaO.Al2O3.Fe2O3; de molaire massa bedraagt 4x40,08 + 2x26,98 + 2x55,85 + 10x16,00 = 485,98 g/mol
b. 2Fe per mol 4CaO.Al2O3.Fe2O3 dus massapercentage Fe bedraagt 2x55,85/374,29 = 29,84%
Opdracht 8.9
a. 10,26 g – 8,11 g = 2,15 g water in 10,26 g gips. Massapercentage water in gips bedraagt 20,96 %.
b. 8,11/136,14 = 0,0596 mol CaSO4
c. 2,15/18,016 = 0,0596 mol H2O
d. 0,50 mol water per mol calciumsulfaat.
e. CaSO4.0,5H2O of 2CaSO4.H2O
f. dicalciumsulfaatmonohydraat
